Cell Metab. (IF=30.9)|上海交大刘军力研究员团队:DLAT抑制亮氨酸分解驱动肿瘤发生
英文标题:Pyruvate metabolism enzyme DLAT promotes tumorigenesis by suppressing leucine catabolism
中文标题:丙酮酸代谢酶DLAT通过抑制亮氨酸分解代谢促进肿瘤发生
发表期刊:Cell Metabolism
影响因子:30.9
研究背景
肝细胞癌(Hepatocellular Carcinoma, HCC)在全球范围内的发病率和死亡率呈显著上升趋势,代谢重编程在其进展过程中扮演着关键角色,主要体现为Warburg效应以及支链氨基酸(BCAA)代谢的异常改变。丙酮酸作为Warburg效应的重要中间产物,其代谢与肿瘤发生密切相关,而丙酮酸脱氢酶(PDH)复合体是连接糖酵解与三羧酸循环(TCA循环)的关键桥梁,其中二氢硫辛酰胺S-乙酰转移酶(DLAT)作为PDH复合体的核心组分,不仅在丙酮酸代谢中通过乙酰基转移参与乙酰辅酶A的生成,还被发现可作为蛋白质乙酰转移酶修饰其他分子,但它在协调其他代谢通路促进肿瘤生长方面的作用尚未明确。
在支链氨基酸代谢中,亮氨酸是激活哺乳动物雷帕霉素靶蛋白复合体1(mTORC1)通路的关键调控因子,它能增强Rag GTPases与Raptor的结合,从而激活mTORC1,维持蛋白质合成信号,推动癌细胞快速生长,且肝癌组织中亮氨酸水平升高与HCC进展显著相关。AU RNA结合甲基戊二酰辅酶A水合酶(AUH)是亮氨酸分解代谢中的关键酶,负责催化生成S-3-羟基-3-甲基戊二酰辅酶A(HMG-CoA),但其代谢活性的调控机制及其在肿瘤进展中的具体作用仍有待深入探究。
鉴于此,本研究旨在探究DLAT是否通过调控亮氨酸代谢参与HCC的发生发展,以期揭示HCC进展的新机制并为其治疗提供新靶点。
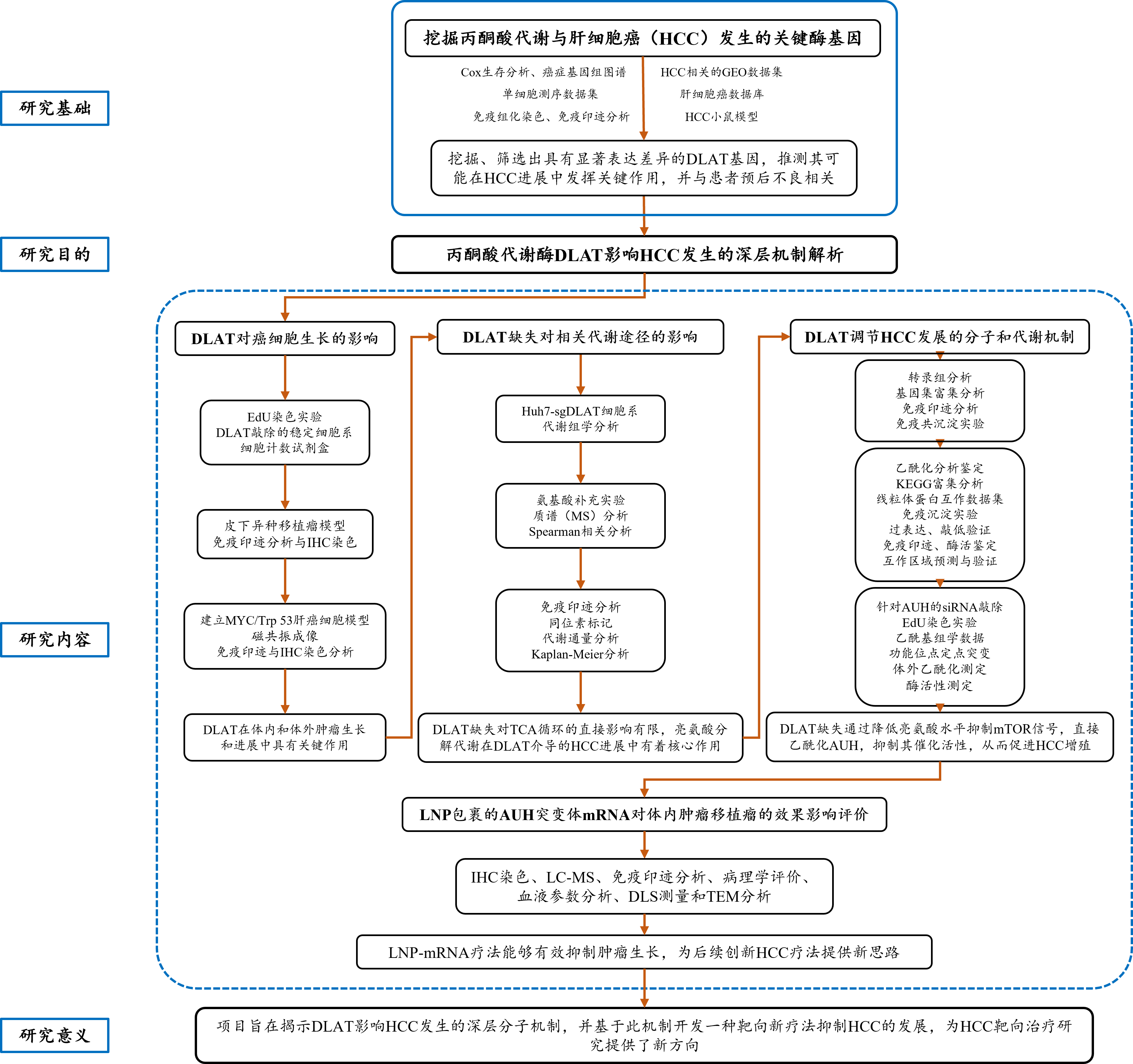
技术路线
研究结果
1、肝细胞癌中DLAT的高表达与不良预后相关
研究者发现丙酮酸代谢中的DLAT与HCC有着紧密的关联:①DLAT在HCC中显著高表达(图1B-D),且其高表达与患者总生存期缩短、疾病特异性生存期和无进展间隔降低密切相关。此外,DLAT也是HCC的独立风险因素;②DLAT在恶性细胞中显著高表达,且其表达水平与恶性细胞比例呈显著正相关(图1E-G);③HCC样本中DLAT表达升高(图1I-L);同样地,DEN诱导模型中也发现DLAT的高表达(图1M-N);④DLAT亦可作为HCC的潜在诊断生物标志物。综上,DLAT不仅在HCC进展中发挥关键作用,其表达水平还可作为预后评估和早期诊断的潜在靶点。
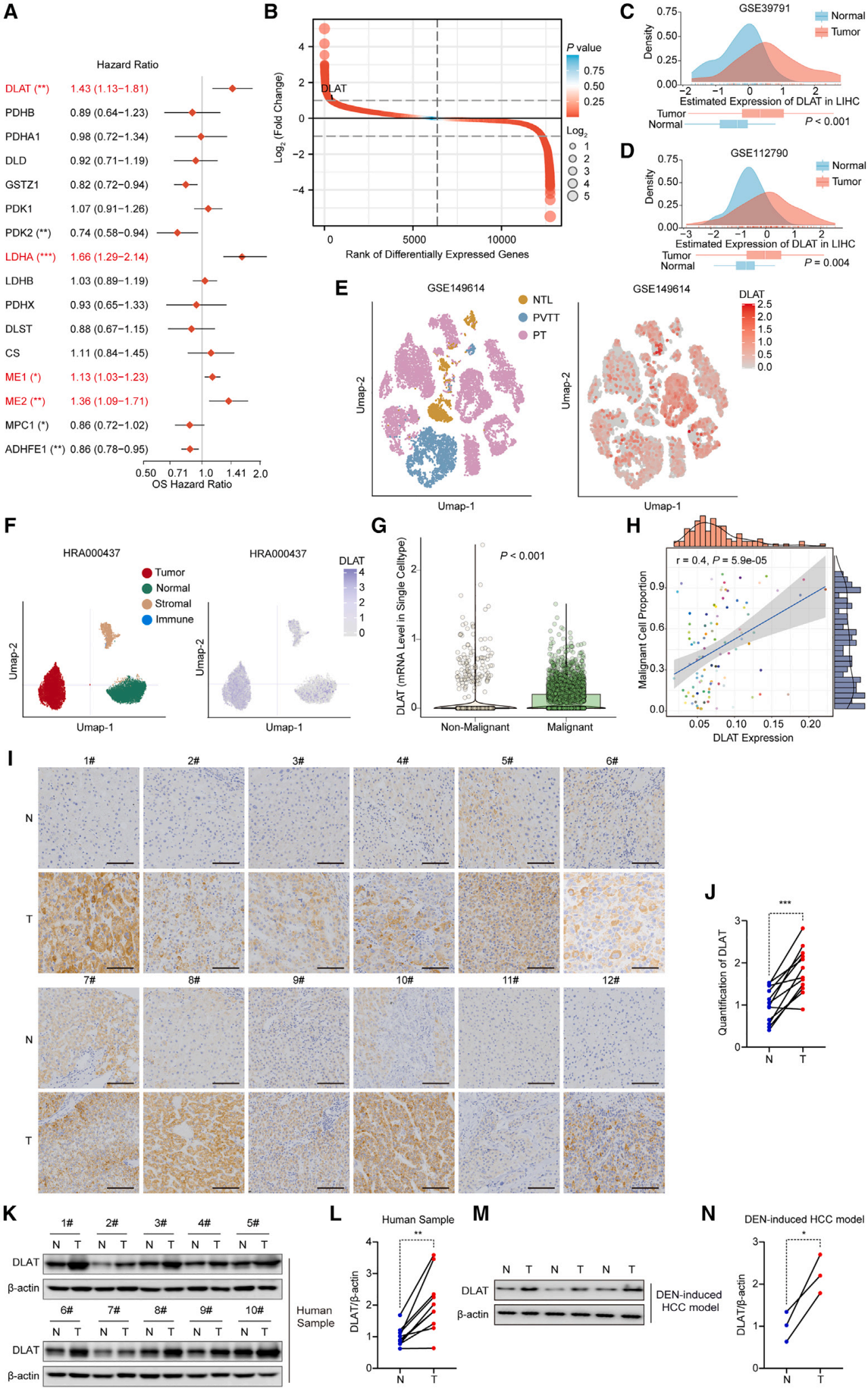
图1. 肝细胞癌中DLAT高表达与不良预后相关
2、靶向DLAT可抑制体外和体内的肿瘤增殖
基于上述结果,研究者推导并验证了DLAT的表达与癌细胞增殖密切相关:
体外实验:DLAT沉默会导致Huh7和HepG2细胞增殖受到显著抑制(图2A-C)。在构建的DLAT敲除稳定细胞系中,HepG2-sgDLAT细胞的生长速率显著低于对照组,CCK8分析结果也与此一致(图2C)。
皮下异种移植模型:为验证DLAT对肝癌进展的作用,采用皮下异种移植模型。结果显示,sgDLAT组肿瘤生长速率、体积和重量显著低于对照组(图2D-F),且不影响小鼠体重。后续实验进一步确认 MHCC-97H-sgDLAT肿瘤中DLAT被高效敲除(图2G-H);Ki-67染色结果也表明,DLAT缺失会抑制HCC增殖(图2H-I)。
AAV-DIO-shDLAT和MYC/Trp53⁻/⁻肝癌模型:为深入研究DLAT在肝癌发展中的关键作用,研究者构建了AAV-DIO-shDLAT和MYC/Trp53⁻/⁻肝癌模型(图 2J)。结果显示,AAV-DIO-shDLAT组在 MYC/Trp53⁻/⁻注射21天后,肿瘤可见性显著降低(图2K);30天后,肝脏肿瘤数量和最大肿瘤体积均显著减少(图2L-N),且肝脏重量无显著变化,同时证实DLAT被高效沉默(图2O-Q)。此外,在HCC样本中,AAV-DIO-shDLAT组的Ki-67表达显著降低(图2P-R)。
其他模型验证:在DEN/CCl₄模型和DEN诱导模型中,也观察到类似结果,即DLAT敲低显著减少肿瘤进展和Ki-67表达。
综上,DLAT在体外和体内均是肝癌增殖和进展的关键驱动因子。
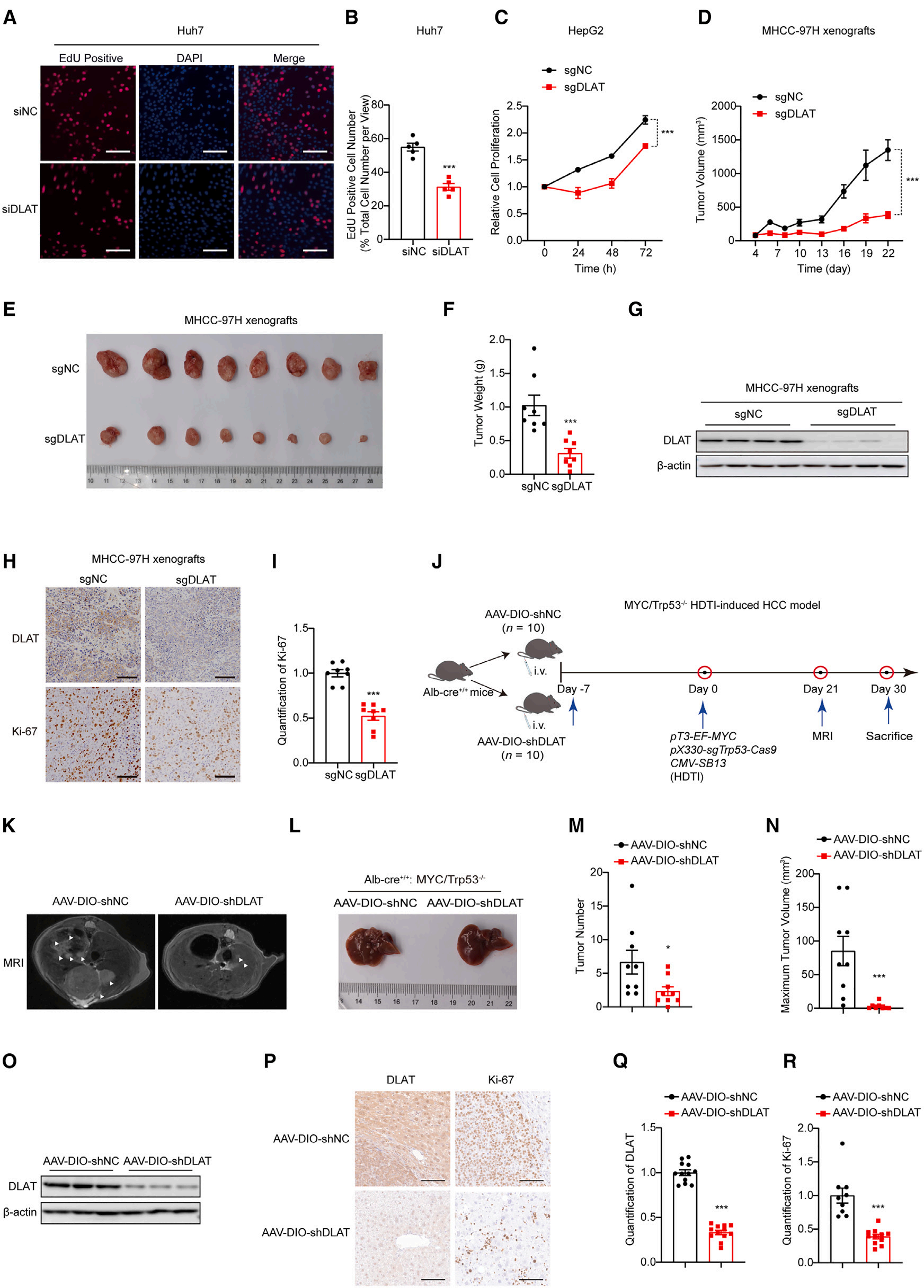
图2. 靶向DLAT可抑制体外和体内的肿瘤增殖
3、DLAT缺失对TCA循环中间产物影响有限,且通过促进亮氨酸分解代谢调控HCC进展
(1)DLAT缺失对TCA循环的影响及补偿机制
对Huh7-sgDLAT细胞及对照细胞的代谢组学分析显示,DLAT缺失仅使细胞内琥珀酸总量下降,对柠檬酸、顺乌头酸等其他TCA循环中间产物无显著影响(图3A)。代谢通量分析证实,DLAT缺失会降低丙酮酸来源的乙酰辅酶A及TCA中间产物水平,但谷氨酰胺可通过分解代谢补偿这一影响——DLAT缺失显著增加谷氨酰胺来源的α-酮戊二酸、顺乌头酸等TCA中间产物,维持循环稳定性。
(2)靶向DLAT促进亮氨酸分解代谢及其核心作用
代谢组学深度分析发现,Huh7-sgDLAT细胞中亮氨酸、天冬氨酸、缬氨酸水平显著下调(图3A-B),质谱分析进一步验证了这一结果(图3E)。功能实验显示,仅补充亮氨酸可逆转DLAT缺失导致的细胞生长抑制(图3C-D),且亮氨酸水平与DLAT mRNA表达呈显著正相关(图3F)。
机制上,DLAT缺失对BCAA相关氨基酸转运体的表达及功能无显著影响(图3G-H),但代谢通量分析表明其可促进亮氨酸分解代谢——sgDLAT组中源自亮氨酸的HMG-CoA和乙酰辅酶A水平升高,而上游代谢物KIC比例不变,提示DLAT不参与亮氨酸转氨反应(图3I-L)。此外,BCAA分解代谢上调与HCC患者更长的总生存期和无病间期相关(图3M-N),证实亮氨酸分解代谢在DLAT介导的HCC进展中起核心作用。
综上,DLAT缺失对TCA循环的直接影响有限,主要通过调控亮氨酸分解代谢影响HCC进展。
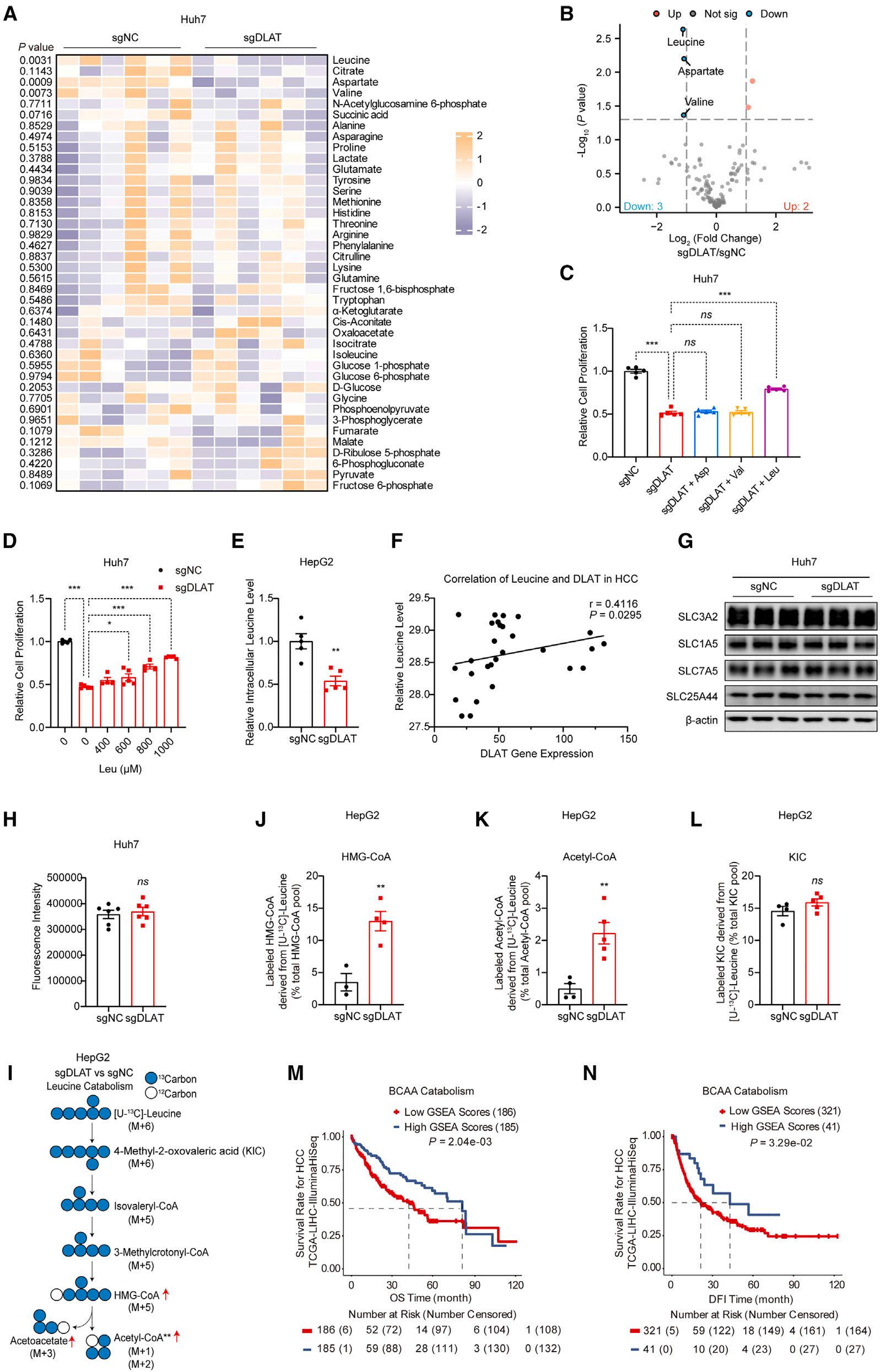
图3. 靶向DLAT可促进肝细胞癌中的亮氨酸分解代谢
4、DLAT缺失通过抑制亮氨酸-mTOR信号通路抑制肝细胞癌增殖
为阐明DLAT调控HCC发展的分子与代谢机制,结合RNA-seq与GSEA分析,发现mTOR信号通路在DLAT高表达组显著富集(图4A-D),且DLAT表达与mTOR信号呈正相关。同时,DLAT缺失也显著抑制mTOR、S6K和S6的磷酸化(图4E-F),表明mTOR信号被阻断。此外,亮氨酸补充能够逆转DLAT缺失导致的mTORC1抑制(图4G),且恢复Rag GTP酶与Raptor的相互作用(图4H),证实DLAT通过亮氨酸调控mTOR信号。另一方面,随着亮氨酸补充,DLAT缺失对HCC细胞增殖的抑制也显著减弱(图4I-J)。同样地,氨基酸信号通路(调控mTOR激活)亦与HCC患者不良预后相关(图4K-L),这些结果都指向着mTOR信号异常与HCC进展密切相关。综上,DLAT缺失通过降低亮氨酸水平抑制mTOR信号,从而抑制HCC的增殖与进展。
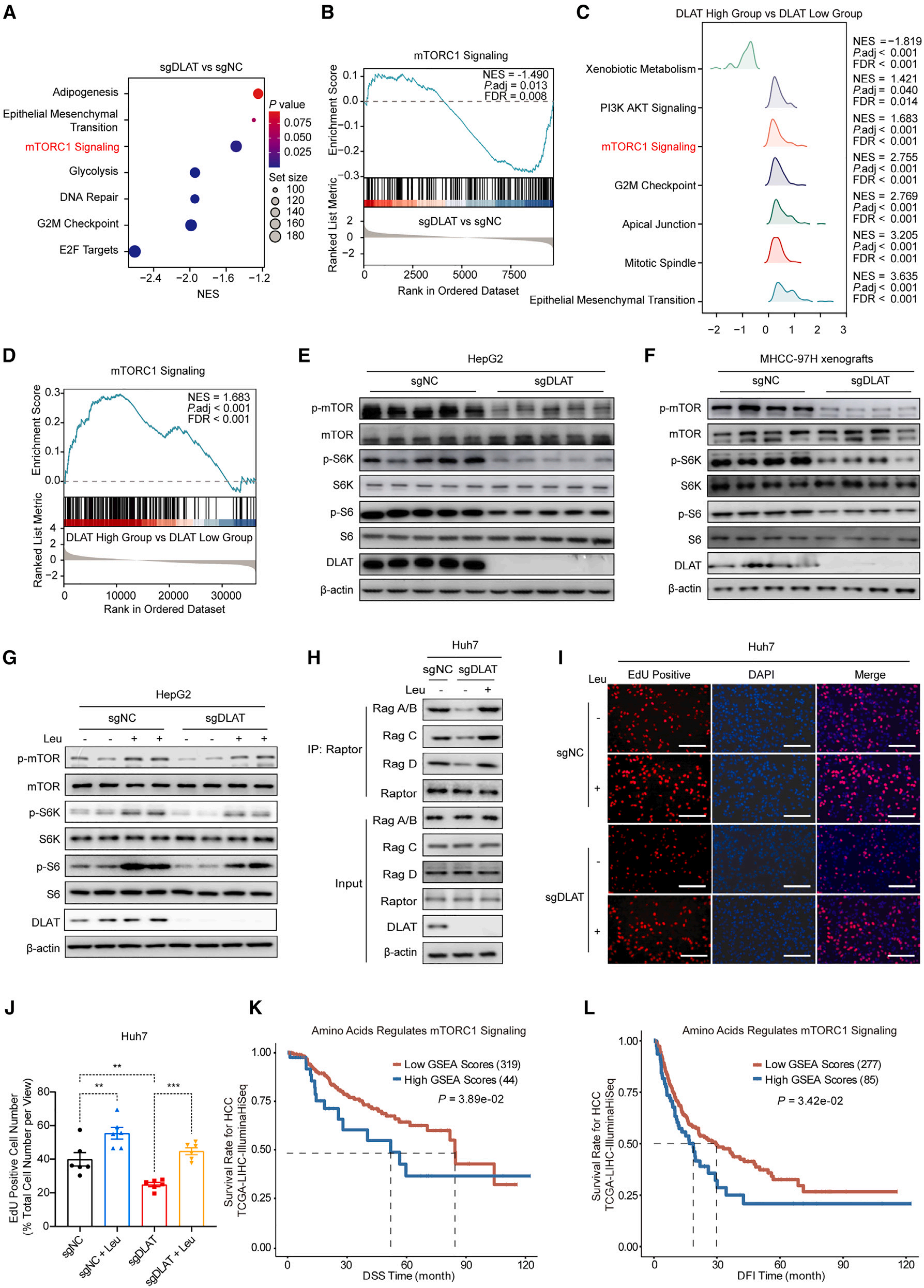
图4. DLAT缺失通过抑制亮氨酸-mTOR信号通路抑制肝细胞癌增殖
5、DLAT作为亮氨酸分解代谢酶AUH的乙酰转移酶发挥作用
为阐明背后潜在的分子机制,研究者先是发现了DLAT的缺失对关键亮氨酸分解代谢酶的蛋白水平影响较小,随后推测出可能是翻译后的修饰调控所致,即DLAT可能通过调控这些分解代谢酶的乙酰化水平来影响亮氨酸代谢。综合乙酰化组深度分析(图5A-B)和KEGG富集(图5C)的结果, DLAT很有可能调控亮氨酸分解代谢酶的乙酰化。
由于亮氨酸代谢酶多定位于线粒体,研究者便在全局线粒体乙酰化水平分析中,发现DLAT的缺失显著降低了部分蛋白的乙酰化水平,随后鉴定出47个与DLAT互作的蛋白(图5D)。结合乙酰化组学结果以及BCAA代谢相关酶数据集,三者交集的AUH,一种亮氨酸分解代谢酶,被确定为DLAT的潜在乙酰化靶点(图5D)。
后经验证,DLAT的过表达确实显著增强了AUH乙酰化(图5E),而DLAT敲除则相反(图5F);体外乙酰化实验亦证实DLAT直接乙酰化AUH(图5G)。联合酶学特性分析,DLAT对AUH的Km值为0.6753 mM(图5H),表明高底物亲和力;反应动力学显示负协同效应(Hill系数≈0.7462)和浓度依赖性(图5I)。
此外,DLAT与AUH在线粒体中共定位(图5J);免疫印迹及coIP的结果都确认两者的直接互作关系(图5K-M);而当C端内域(DI)缺失时互作会被破坏,表明C端区域对互作至关重要。
综上,DLAT直接与AUH互作并调控其乙酰化水平。
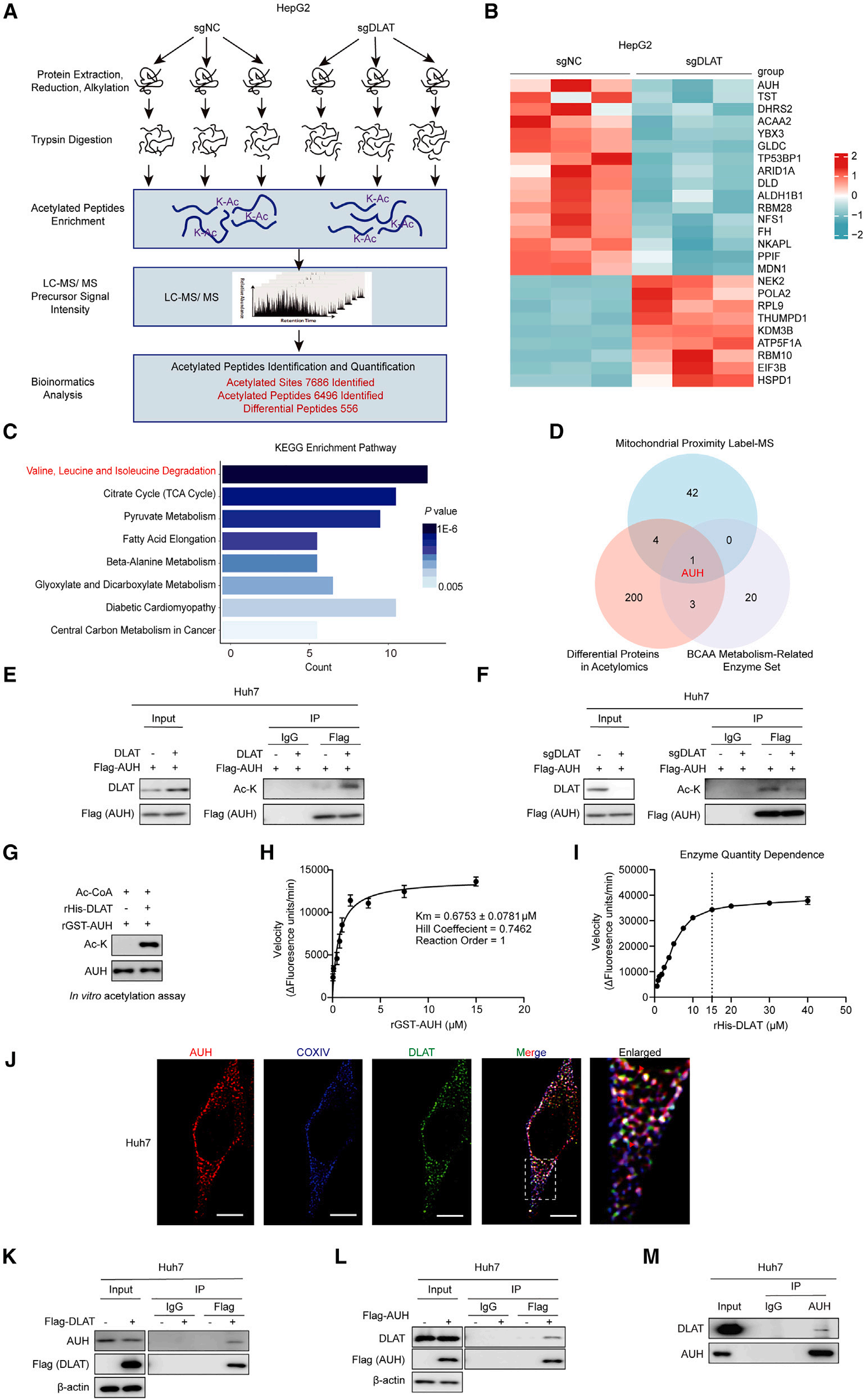
图5. DLAT作为亮氨酸分解代谢酶AUH的乙酰转移酶发挥作用
6、DLAT介导的AUH在K109位点的乙酰化促进肝细胞癌进展
在Huh7-sgDLAT细胞中,其生长速率显著低于对照组(图6A),而此却能够通过AUH敲低逆转其细胞生长抑制(图6A)。而在EdU染色实验中,亦观察到类似结果,即AUH敲低缓解了DLAT缺失对HCC细胞增殖的抑制作用(图6B-C)。此外,AUH敲低也减弱DLAT缺失后亮氨酸水平的下降(图6D),表明DLAT依赖AUH调控亮氨酸代谢。
为探索背后调控机制,结合乙酰化组学数据(图 5A),鉴定出AUH的三个潜在乙酰化位点:K109、K160和K211(图6E)。而其中的K109被成功验证,其应是此调控网络中关键位点(图6E-G),同时此位点在物种间高度保守(图6H)。
将K109位点突变,命名为AUHK109R,在酶活性验证中,能够发现突变体的催化活性显著高于野生型,证实K109乙酰化抑制AUH功能(图6I)。此外,AUHK109R过表达还会抑制mTOR的激活(图6J),EdU染色也显示其增殖抑制(图6K-L)。
综上, DLAT直接乙酰化AUH的K109位点,抑制其催化活性,从而促进HCC增殖。
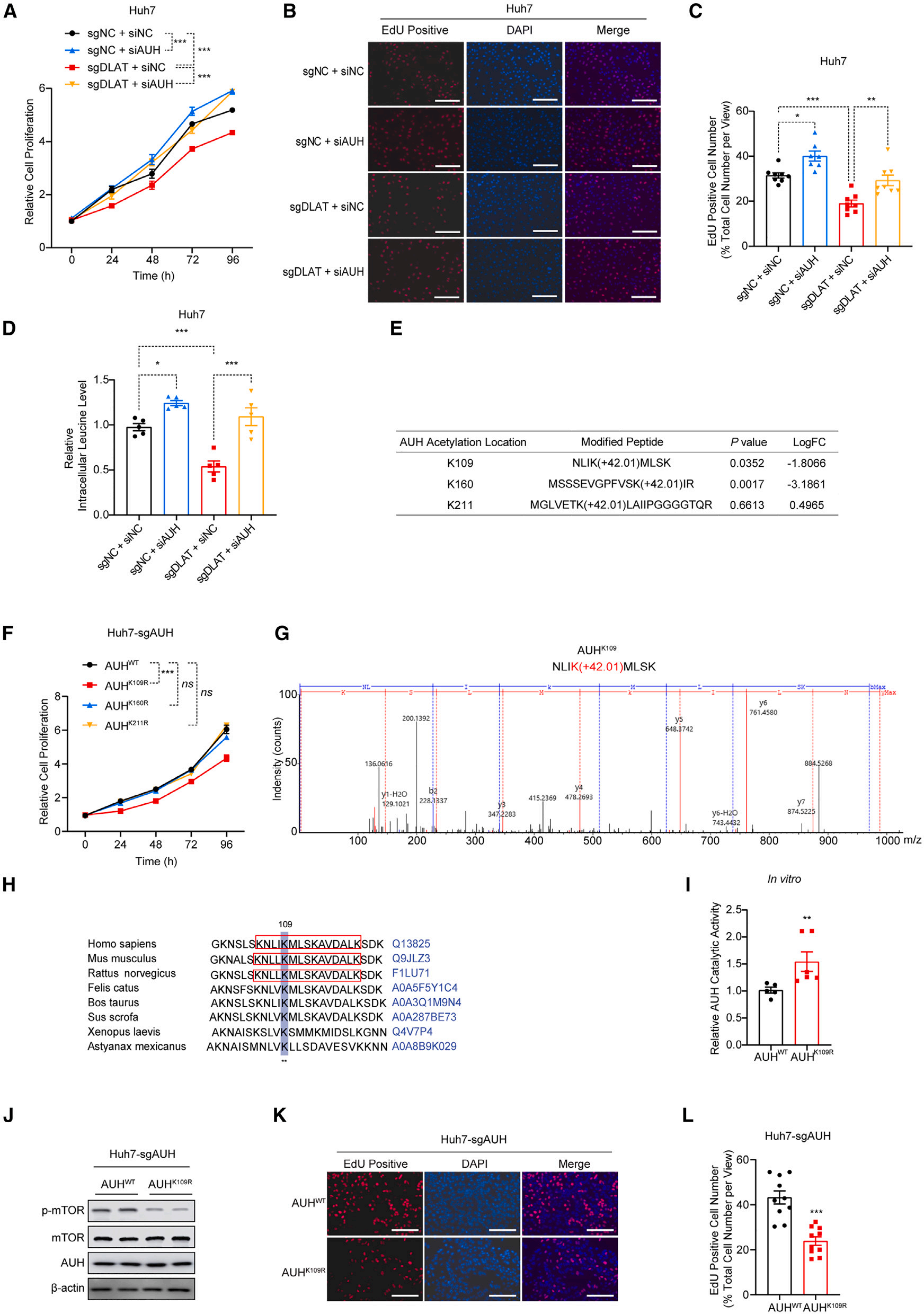
图6. DLAT通过K109位点乙酰化抑制AUH活性
7、脂质纳米颗粒包装的AUH突变体mRNA有效抑制体内肿瘤异种移植物的生长
基于上述研究,研究者构建了脂质纳米颗粒(LNP)封装的AUHK109R突变体mRNA作为新的治疗方案。结果显示,此方案能够显著抑制MHCC-97H异种移植瘤的生长 ,其肿瘤体积(图7A-B)和重量(图7C-D)均显著降低,且各组小鼠体重无显著差异,同时对肿瘤增殖和干细胞特性也表现出抑制作用(图7E-G)。
检测皮下移植瘤中的亮氨酸水平,发现颗粒治疗组中的亮氨酸水平显著降低(图7H),推测AUH功能异常可能与亮氨酸代谢紊乱相关。另外,该组中mTOR激活被显著抑制(图7I)。
在治疗作用方面,与对照组相比,治疗组的肿瘤体积和重量显著降低(图7K),Ki-67和EpCAM表达水平(图7L-N)和mTOR磷酸化水平也都显著下降(图7O),但三组小鼠体重无显著差异。在安全性评估方面,该方案在BALB/c裸鼠中,对正常组织无明显毒性。
综上所述,该方案能够显著抑制HCC肿瘤的生长,且在体内具有良好的安全性,为HCC治疗提供了新的策略。
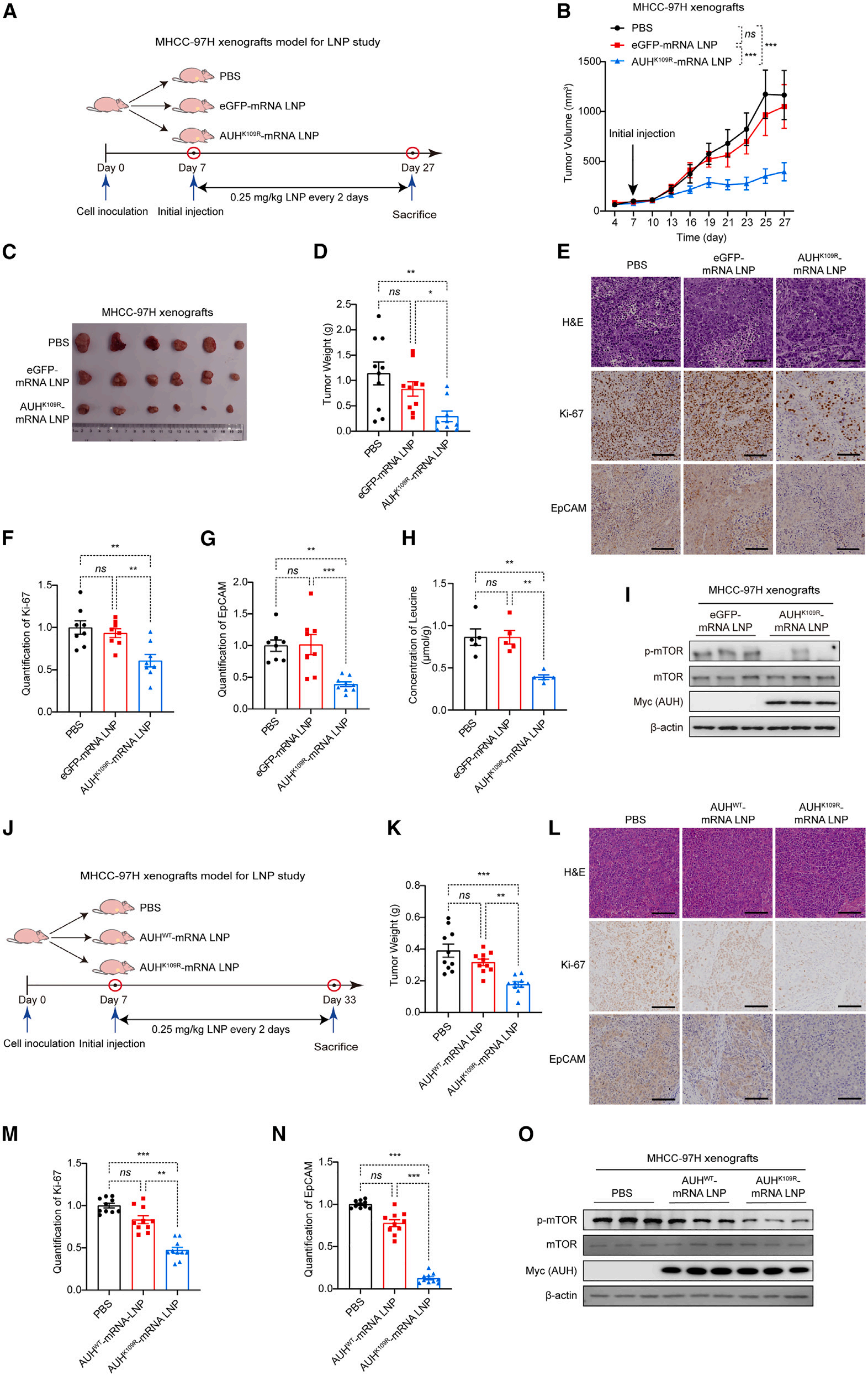
图7. 脂质纳米颗粒包装的AUH突变体mRNA有效抑制体内肿瘤异种移植物的生长
研究结论
本研究聚焦丙酮酸代谢酶DLAT在HCC中的作用及机制,发现DLAT在HCC中高表达且与患者不良预后密切相关。其通过直接乙酰化亮氨酸分解代谢酶AUH的K109位点,抑制AUH活性,导致亮氨酸积累并持续激活mTORC1信号通路,从而促进肿瘤增殖。基于此,研究团队开发的AUHK109R-mRNA脂质纳米粒(LNP)治疗策略,可有效恢复亮氨酸分解代谢、抑制mTOR激活,在体内显著抑制HCC生长且安全性良好,为HCC治疗提供了新靶点和潜在治疗方案。
百趣生物非靶标代谢流检测分析技术,依托稳定同位素标记,是突破普通代谢组学局限的核心工具。普通代谢组学仅能提供静态代谢物丰度信息,难以应对动态复杂的代谢网络,而该技术可完美弥补这一不足。它不局限于特定通路,通过添加13C或15N标记底物,追踪其在生物系统中的代谢轨迹,清晰反映细胞代谢过程与网络动态变化,精准揭示遗传或环境扰动下的代谢重编程规律。BIOTREE基于LC-MS/MS平台的非靶标代谢流检测分析方法,适用于临床及动、植物样本,能全面解析代谢流量的动态变化,定量分析代谢途径流量,助力代谢组学研究迈向更高层次。
若您对“非靶标代谢流检测分析技术”服务感兴趣,百趣生物可提供专业技术服务,欢迎后台私信咨询!
END
Run動 撰文
Winly 校稿
